ガンの天敵を創る 目次へ
-ガン遺伝子治療の新戦略-
- 1.背景
- (1)伴侶動物の癌 -遺伝子治療にかける夢-
現在の日本人の死因の30%は癌である。抗体治療薬などの目覚ましい進歩にもかかわらず、生存率の著明な改善には至っていない。また、ヒトばかりでなく、近年、パートナー・アニマル(伴侶動物)においても高齢化が進み、それと共に癌罹患率も上昇して、日本、米国ともに、イヌの死因の第一位は悪性腫瘍となった。
がんの新しい治療法として、ヒト、動物ともに遺伝子治療に大きな期待が寄せられている。しかし、精力的な研究が20年以上に渡って行われてきたにもかかわらず、効果が確立され、承認された遺伝子治療薬はまだほとんど無い。
動物の癌に関しては、その治療法が全く確立されておらず、特に動物では癌が進行癌として発見されることが多いため、現在使用されている一般の抗がん剤(主にヒト用医薬品を転用)の使用では、手術後の腫瘍再発率はほぼ100%であり、その予後は極めて悪い。
本プロジェクトでは、動物の癌治療を目的とした、治療効果の高い遺伝子治療薬の開発を目的とする。
- (2)癌遺伝子治療の現状
- a.ウイルス・ベクターの試みと限界
しかし、生体内に投与されたウイルスは、速やかに抗体によって中和されるため、その機能は著しく低減される。また、ウイルス自体の高い毒性のため、投与形態は厳しく制限される。そのため、ウイルスを用いた遺伝子治療で腫瘍に対して十分に高い治療効果を示したものはほとんど報告がない。
さらに、1999年には米国でアデノウイルスを用いた遺伝子治療において死亡事故が起き、2001年(仏)、2007年(英)のレトロウイルス製剤による白血病様症状の発症、2007年には米国でアデノ随伴ウイルスの投与直後の被験者の死亡など、重大な副作用が報告され、ウイルスベクターの安全性が問題となっている。
また、ウイルスによる遺伝子治療は、カルタヘナ法による規制、投与後の患者の隔離の問題があり、動物治療への適用は困難である。
- b.非ウイルス・ベクターへの期待と問題点
しかし、これらの非ウイルス・ベクターは培養細胞では高い遺伝子発現を実現できるものもあるが、in vivo実験で生体内での遺伝子発現は極めて低い。そのため、非ウイルスベクターの臨床応用は未だ挑戦の域を出ていない。
- 2.非ウイルスベクターの実用化への試み
- (1)生体内で発現しない原因とこれまでの取り組み
始めに、どうして培養細胞上では効率よく発現するものが、生体内で全く働かなくなるのか解析した。非ウイルスベクターが、生体内でほとんど遺伝子発現しない主な原因として、
● 生体成分との非特異的な相互作用
● 大きすぎる複合体サイズ
の二点が挙げられる。以下、順に考察する。
- a.生体成分との非特異的な相互作用
DNAは比較的堅い剛直な高分子であるため、安定な複合体を得るためにはカチオン成分を過剰に加える必要がある。そのため、生成するDNA複合体は、その表面がプラスに帯電している。
一方、ほとんどの細胞表面や多くのタンパク、細胞外マトリックスはマイナスに帯電している。そのため、プラスに帯電したDNA複合体は、生体組織と非特異的に相互作用し、血球凝集、補体の活性化などの好ましくない生理反応を引き起こす。
DNA複合体粒子が、生体成分との非特異的な相互作用をせずに、生体内で安定に分散し続けるためには、表面のプラスチャージがシールドされる必要がある。これまで他の研究グループによって、以下のような試みが報告されている。
1.中性ポリマーによるDNA複合体のコーティング 予め作製したDNA複合体に活性エステルを側鎖に持つ中性ポリマーを加えて反応させ、 DNA複合体の表面に中性ポリマーを植え付けることで血中滞在性を向上させる方法(K.D. Fisher et al, Gene Ther. 7, 1337 (2000))。しかし、このような粒子表面の化学修飾は基本的に不均一反応なため制御が難しく再現性が悪い。
2.ポリカチオンをDNAと混合する前に、予め中性ポリマーと化学接合させる方法 (M.A. Wolfert et al. Hum Gene Ther. 17, 2123 (1996))。 ポリカチオンを中性ポリマーと結合させてしまうと、DNAと複合体を形成しにくくなり、期待通りの複合体形成が困難になる。
- b.大きすぎる複合体サイズ
直接腫瘍局所内にDNA複合体を投与した場合でも、組織の中で複合体粒子が効率良く拡散するためには、その粒子経は数十ナノメートル以下が望まれる。
しかし、十分に小さな複合体は調製が非常に困難であり、最も重要な未解決の問題点として指摘され続けてきた。特に、生体内への投与で用いるような比較的高濃度 ([DNA]>0.5 mM in base)の条件下では、DNAとポリカチオンは混合直後から大きな凝集体となって生成し、時間と共にさらに凝集して直径数ミクロン以上の巨大な塊とな る。このような巨大粒子では、生体・組織内での拡散性が非常に悪く、標的細胞への効率良いデリバリーは望めない。これまで、DNAとカチオン性界面活性剤 とで微粒子を形成させたのち界面活性剤のカップリングで粒子を安定化する方法や、DNA/ポリカチオン複合体粒子を橋掛けして凝集を防ぐ手法などが試され てきたが、いずれも遺伝子導入活性の大きな低下を伴い、有効な解決法が見つかっていなかった。
- 3.三元複合体による難問の解決 -生体内で高発現する遺伝子ベクターの実現-
- (1)生体内で高発現する遺伝子導入システムの開発
- a.生体成分との非特異的な相互作用の解決
一方我々は、ある特定の構造のポリアニオンは、DNA/ポリカチオン複合体に加えるても、これを分解することはなく、その表面をコートして、表面がマイナスに帯電した三元複合体を形成することを見出した。
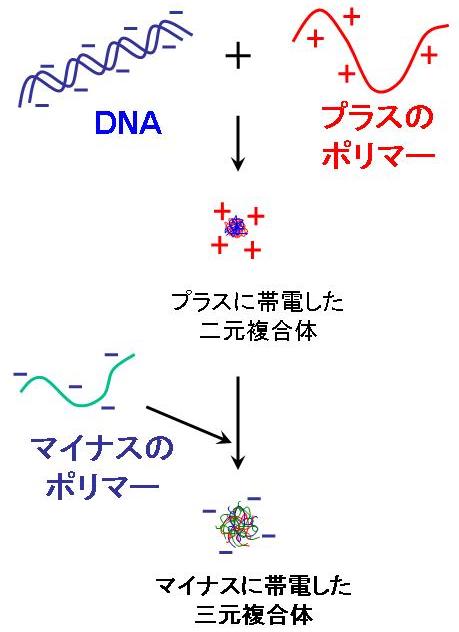
このようなポリアニオンの保護コーティングによって血中成分との相互作用は効果的に低減された(Y. Koyama et al. J. Biomater. Sci. Polymer Edn. 14, 515 (2003); T. Ito et al. J Control Release. 112, 382 (2006))。
また、腫瘍細胞に特異的に接着するリガンドをポリアニオンに導入することによって細胞特異的な遺伝子導入が可能となった(K. Maruyama et al. Biomaterials. 16, 3267 (2004))。さらに、ポリアニオンコーティングは、それまでほとんど解決策の無かった、DNA複合体の被転写効率をも効果的に向上させた。
- b.大きすぎる複合体サイズの解決
ところが、DNA/ポリカチオン複合体は分散が不安定で凝集しやすいため、微小な粒子を凝集させずにそのまま濃縮する手法がなかった。
我々は、ポリアニオンで被覆した三元複合体極粒子の分散が非常に安定であることを見出した。そして、いったん高希釈下で極微細な複合体粒子を調製し、これを凍結乾燥・再水和の過程で濃縮することによって、生体内での遺伝子導入に適応可能な、高濃度で微小な粒子の分散体を得ることに初めて成功した。
- <生体内での遺伝子高発現の実現>
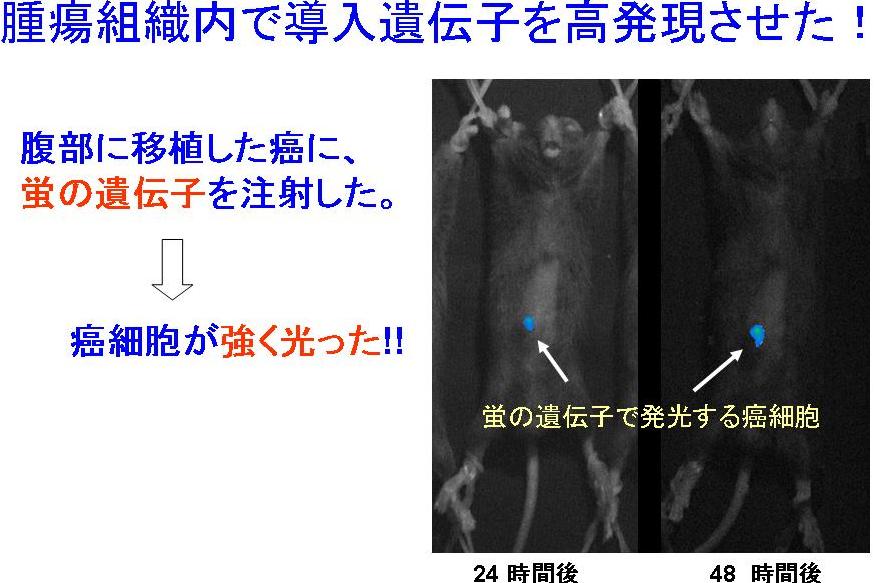
- 4.高発現DNA複合体システムの癌治療効果
<サイトカイン遺伝子の導入>
- (1)担癌モデル動物における著しい治癒効果
下図のように、GM-CSF遺伝子をコードしたDNA複合体を投与したマウスでは、腫瘍が完全に消滅し、120日以上経過しても再発は見られず、このような極微小なDNA複合体の高い治癒効果が確認された。
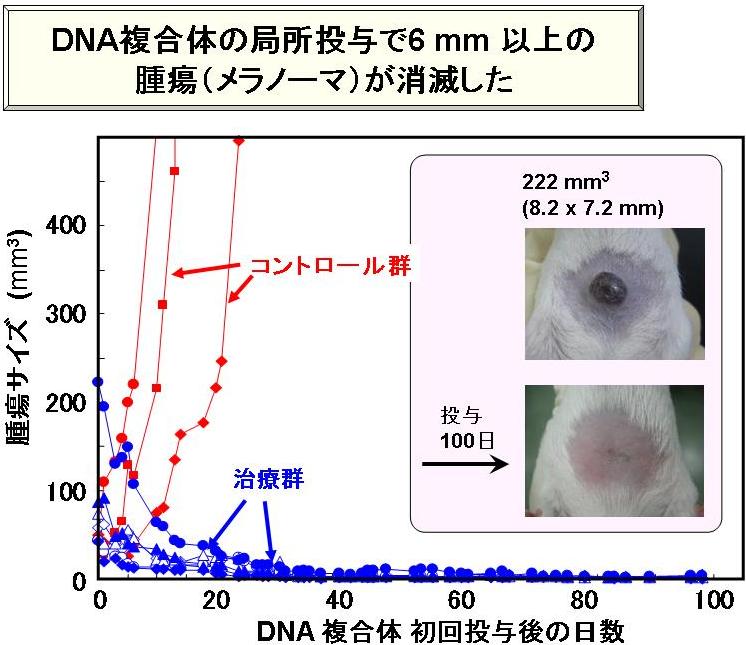
-
ガンを逃がさない
- (2)さらなる高い治療効果を求めて -微生物抗原遺伝子を用いた癌治療-
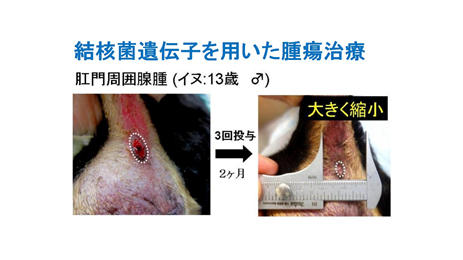
<結核菌タンパクでガンをマーキング>
これらの強敵を退治するには、ただ免疫を強化するだけではしばしば不十分であると考えた。そこで、免疫を回避しているガン細胞が、再び免疫系の監視網にかかるようにするため、微生物由来の強い抗原タンパクをガン細胞に発現させることを試みた。
- <結核菌遺伝子が癌をなおす!>
- 5.動物臨床研究で証明された高い抗腫瘍効果
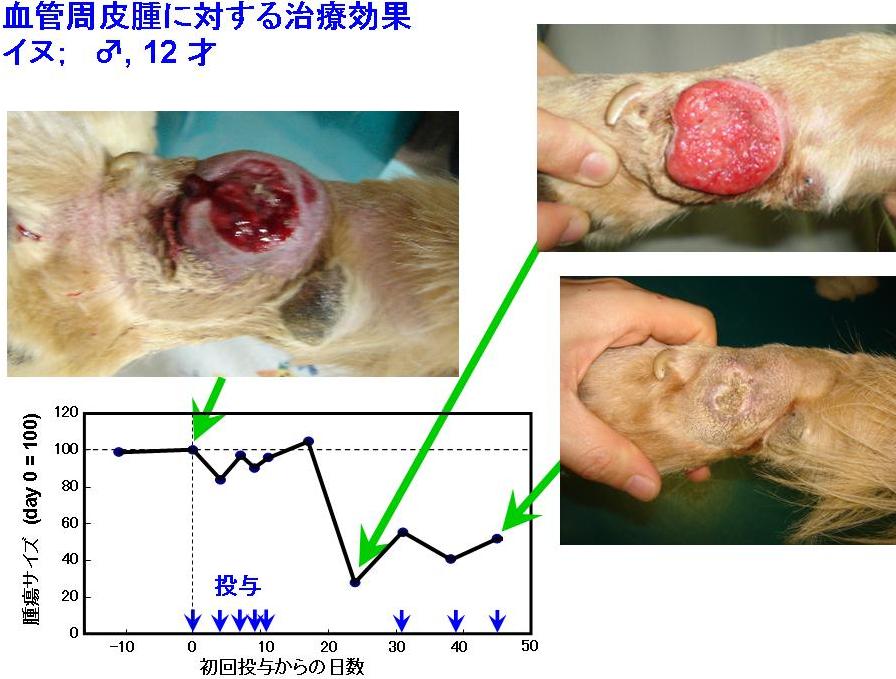
そこで、これらのシステムが、自然発生の腫瘍に対しても効果を持つのか、イヌ、ネコの原発性の癌に対する治癒効果を、動物病院における臨床研究により検討した。
- (1)免疫活性化サイトカイン遺伝子による動物臨床研究
- (2)結核菌抗原遺伝子による動物臨床研究
- 6.抗腫瘍動物遺伝子治療薬の可能性
- (1)マーケット状況
一方、動物医療の市場も増大を続けており、21世紀に入って動物医薬の総売上は100億ドルを超えた。ペットの医療産業の拡大もめざましく、アメリカでは2001年のイヌの総医療費は1兆1千億円、猫は5700億円にのぼり、年間でイヌ一匹あたり、平均178.5ドルの医療費がかかった計算になる。
- (2)製剤化の意義と価値
本プロジェクトで開発したDNA微粒子複合体は、動物の腫瘍に対して優れた治癒効果を持つことが確認された。これらの製剤は、予め調製済みの複合体を、冷蔵保存の可能な固体状の凍結乾燥体とし、これらを再水和して使用するため、使い勝手の良い、簡便かつ安全な遺伝子導入試薬として、臨床現場で大いに利用価値が有り、国内、国外で大きな需要が見込まれる。取り扱い、保存安定性にも優れていることから、新しい動物用抗腫瘍遺伝子治療医薬として、あるいは新しい戦略のDNAワクチンとして、高い臨床応用の適合性を持ち、開発すべき価値を充分に有するものと判断される。
お問い合わせはこちら
トップへ戻る